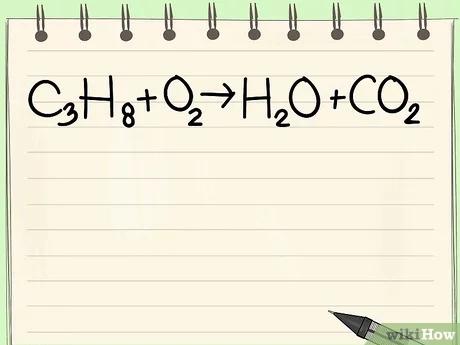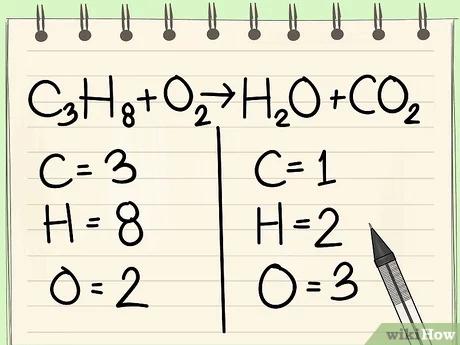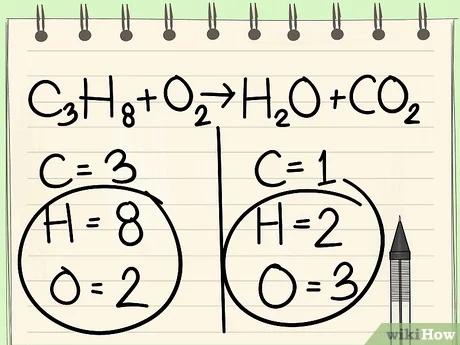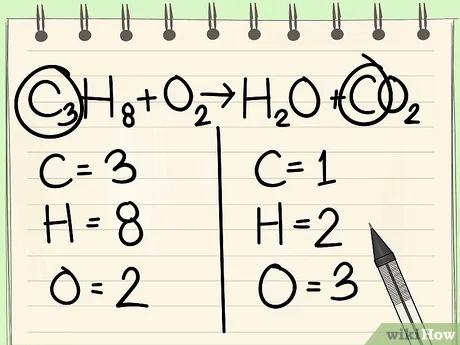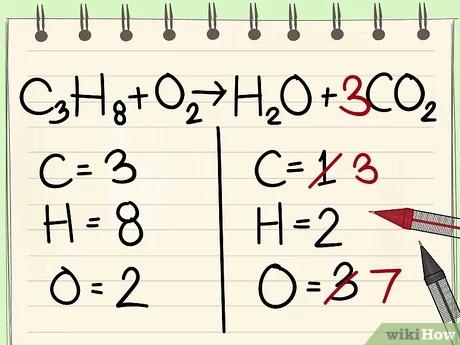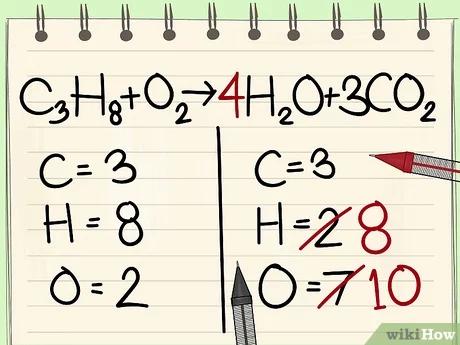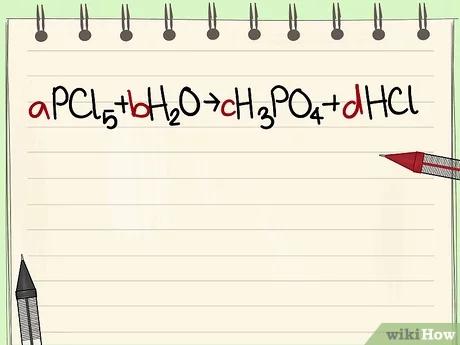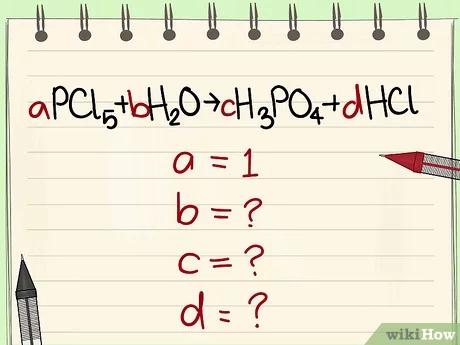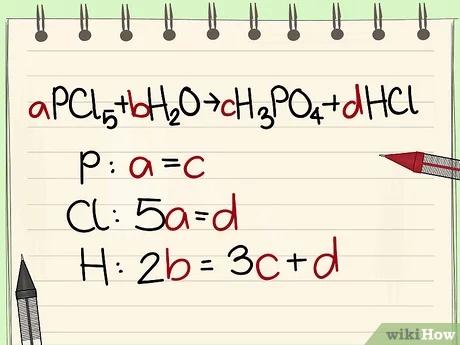كيفية موازنة المعادلات
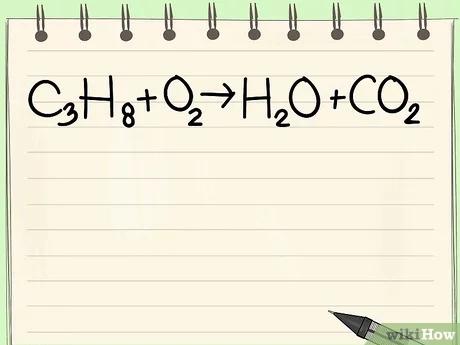
2023-06-20 19:02:48 (اخر تعديل 2023-06-20 19:02:48 )
بواسطة
ويكي كيف
إنّ المعادلة الكيميائية عبارة عن تمثيل رمزي مكتوب عن تفاعل كيميائي حقيقي، حيث يتم كتابة المتفاعلات على الجهة اليسرى من المعادلة، وكتابة النواتج على الجهة اليمنى منها. وينصّ قانون حفظ الكتلة على أنّه لا يمكن تدمير الذرّات أو إيجادها من العدم في تفاعل كيميائي، ولذلك فإنّ عدد الذرّات في المتفاعلات يجب أن يعادل عدد الذرّات في نواتج المعادلة. اتبع هذه الخطوات الإرشادية لتعلّم كيفية موازنة المعادلات الكيميائية بطرق مختلفة.
الخطوات
طريقة 1
طريقة 1 من 2:
وزن المعادلات بالطريقة التقليدية
1
قم بكتابة المعادلة التي ترغب بوزنها. سوف نستخدم المعادلة التالية كمثال:
- C3H8 + O2 --> H2O + CO2
- يحدث هذا التفاعل الكيميائي عندما يحترق غاز البروبان (C3H8) في وجود الأكسجين لإنتاج الماء وثاني أكسيد الكربون.
2
قم بكتابة عدد ذرّات كلّ عنصر من عناصر التفاعل على جهتيّ المعادلة. كي تستطيع إيجاد عدد الذرّات ابحث عن العدد السفلي المكتوب إلى يمين كلّ ذرّة من ذرّات المعادلة.
- الجهة اليسرى من المعادلة: عدد ذرّات الكربون 3، وعدد ذرّات الهيدروجين 8، وعدد ذرّات الأكسجين 2.
- الجهة اليمنى من المعادلة: عدد ذرّات الكربون 1، وعدد ذرّات الهيدروجين 2، وعدد ذرّات الأكسجين 3.
3
اترك الهيدروجين والأكسجين كخطوة أخيرة دائمًا.
4
ابدأ بعنصر واحد فقط. إذا تبقي لديك أكثر من عنصر واحد تريد موازنته: قم باختيار العنصر الذي يظهر في جزيء واحد فقط من المتفاعلات، وجزيء واحد فقط من النواتج. بالاعتماد على هذه القاعدة، سوف نقوم بموازنة ذرّات الكربون أوّلا.
5
قم بإضافة مُعامل لذرّة الكربون الوحيدة الموجودة على الجهة اليمنى من المعادلة لوزنها مع ذرّات الكربون الثلاث الموجودة على الجهة اليسرى من المعادلة.
- C3H8 + O2 --> H2O + 3CO2
- إنّ المُعامل 3 الموجود إلى يسار الكربون على الجهة اليمنى من المعادلة يُشير إلى وجود 3 ذرّات كربون، كما هو الحال مع العدد السفلي إلى يمين ذرّة الكربون على الجهة اليمنى من المعادلة حيث يشير أيضًا إلى وجود 3 ذرّات كربون.
- في المعادلات الكيميائية، يمكنك تغيير المُعاملات الموجودة إلى يسار الذرّات، ولكن لا يمكنك تغيير العدد السفلي إلى يمين الذرّات مطلقًا.
6
قم الآن بوزن ذرّات الهيدروجين. بما أنّ لديك 8 ذرّات في جانب المتفاعلات، سوف نحتاج إلى 8 كذلك في جانب النواتج.
- C3H8 + O2 --> 4H2O + 3CO2
- بما أنّ لديك عدد 2 ذرّات هيدروجين على الجانب الأيمن كما يشير العدد السفلي إلى يمين الهيدروجين، فإننا قد قمنا بإضافة المُعامل 4 إلى يسار الهيدروجين كي نقوم بوزنها مع الذرّات الثمان في الجهة اليسرى من المعادلة.
- عندما نقوم بضرب المُعامل 4 في عدد ذرّات الجزيء الواحد المُمثّلة في العدد السفلي 2 ينتهي ذلك بنا إلى وجود 8 ذرّات ممّا يجعل الهيدروجين موزونًا على طرفيّ المُعادلة.
- أمّا ذرّات الأكسجين الستّ المتبقية فهي نتيجة 3CO2. (3×2=6 ذرّات من الأكسجين + 4 ذرّات أخرى = 10)
7
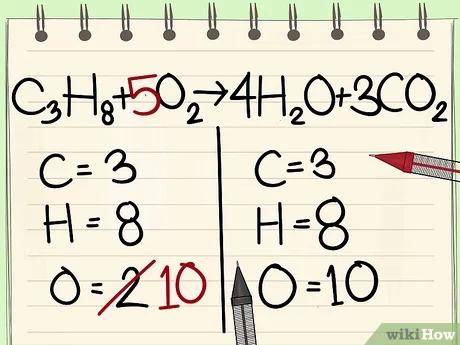
قم بموازنة ذرّات الأكسجين.
- حيث أنّنا قد قمنا بإضافة مُعاملات إلى الجزيئات الموجودة على الجانب الأيمن من المعادلة، فقد تغيّر عدد ذرّات الأكسجين، فلديك الآن 4 ذرّات أكسجين في جزيء الماء، بالإضافة إلى 6 ذرّات أكسجين في جزيء ثاني أكسيد الكربون ممّا يجعل الحصيلة 10 ذرّات أكسجين على جانب المعادلة الأيمن.
- قم بإضافة المُعامل 5 إلى جزيء الأكسجين على الجانب الأيسر من المعادلة، ممّا يجعل لديك 10 جزيئات أكسجين على كلّ جانب.
- C3H8 + 5O2 --> 4H2O + 3CO2.
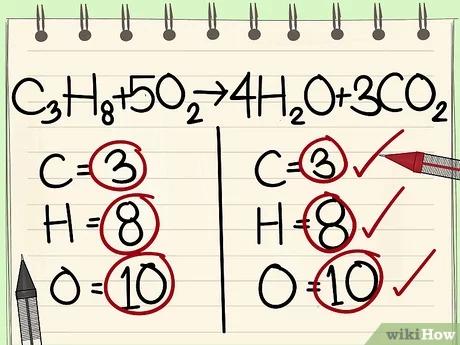
- بما أنّ ذرّات الكربون، والهيدروجين، والأكسجين موزونة الآن، لقد أتممت وزن هذه المعادلة الكيميائية بنجاح.
طريقة 2
طريقة 2 من 2:
وزن المعادلة بالطريقة الجبرية
1
قم بكتابة المعادلة الكيميائية باستخدام الرموز والصيغة. اعتبر مثلا a=1 واكتب المعادلة الرياضية اعتمادًا على الصيغة.
2
قم باستبدال كلّ عدد بالمتغيّر الخاص به.
3
قم بإيجاد عدد العناصر الموجودة في جانب المتفاعلات، وأيضًا في جانب النواتج.
- مثال: aPCl5 + bH2O = cH3PO4 + dHCl ليكن a=1 b= c= d= ثم قم بفصل العناصر وهي P, Cl, H, O، بالتالي ستحصل على a=1 b=4 c=1 d=5.
أفكار مفيدة
- تذكّر تبسيط الأمور دائمًا
- إذا ما وجدت نفسك متحيّرًا، يمكنك إدخال المعادلة إلى موازن معادلات على الإنترنت لوزنها. ولكن تذكّر أنّك لن تتمكن من استعمال أداة لموازنة المعادلات على الإنترنت عند خضوعك لاختبار، ولذلك حاول ألّا تعتمد على ذلك دائمًا.
تحذيرات
- للتخلّص من الكسور، قم بضرب المعادلة بالكامل (الجانب الأيمن والجانب الأيسر) في مقام الكسر.
- تجنّب استخدام الكسور كمعاملات في المعادلات الكيميائية--فإنّك لا تصنع نصف جزيء أو نصف ذرّة في تفاعل كيميائي مطلقًا.
- يمكنك استخدام الكسور أثناء عملية الوزن لمساعدتك فقط، ولكن لا تكون المعادلة موزونة طالما وجدت مُعاملات تحتوي على كسور فيها.